EQUILIBRIO DE FASES DE SISTEMAS BINARIOS
Equilibrio
Liquido-Vapor
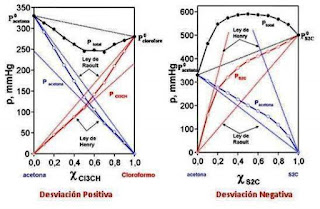
Desviaciones con respecto a la ley de Raoult
Cuando
en un sistema hay una interacción entre las moléculas de los componentes A y B,
la presencia de alguna de ellas afectara a la tendencia del escape de la otra.
Existen dos tipos de desviaciones de la ley de Raoult: las desviaciones
negativas y las positivas.
Ø Desviacion positiva de la ley de Raoult: Cuando se sabe que el compuesto B tiene fuerzas
intermoleculares mayores que las de A, ocurrirá que agregar más moléculas de B
al líquido A será aumentar el escape de este último; así tendrá como resultado
que la presión de vapor de A será mayor que la del líquido puro.
Ø Desviación negativas de la ley de Raoult: Cuando las moléculas de A tienen fuerza de interacción mucho más fuertes
contra B que consigo mismas, la presión de vapor del componente A será menor
que la del liquido puro.
Grafica de cómo son las
desviaciones
Azeótropo
Es
una mezcla que tiene una composición definida de dos o más componentes químicos
que está hirviendo a una temperatura constante y si comportan como si fuesen un
solo componente. Pueden hervir a una temperatura mayor, menor o igual a la de ebullición
a la de los componentes de la mezcla, pero no se pueden separar por una destilación
simple o por alguna extracción liquido-vapor. Los Azeótropos de ebullición máxima
o mínima son los que hierven a una temperatura máxima o mínima, y es más común ver
la mínima que la máxima.
Existen
varios tipos de Azeótropos: Positivos, negativos, homogéneos, heterogéneos.
Ø Azeótropos positivos: cuando el azeótropo ya sea binario o ternario,
tiene una temperatura de ebullición menor que la de sus componentes, se
considera un Azeótropo positivo, porque el comportamiento de la mezcla tiene
una desviación para la ley de Raoult.
Ø Azeótropos negativos: cuando el azeótropo ya sea binario o ternario,
tiene una temperatura de ebullición mayor que la de sus compuestos, se
considera un Azeótropo negativo, porque el comportamiento de la mezcla tiene
una desviación para la ley de Raoult.
Ø Azeótropos homogéneos: cuando los componentes de la mezcla no son
totalmente miscibles, se puede encontrar un azeótropo sobre un agujero, ya que habrán
dos fases allí, una liquida sobre la fase vapor.
Ø Azeótropos heterogéneo: cuando los componentes son miscibles y están fuera
de la zona de inmiscibilidad, se considera homogéneo.
Diagrama de fases de los Azeótropos
Destilación fraccionada
La
destilación fraccionada es un procedimiento químico para poder separar mezclas
que normalmente son homogéneas y binarios, mediante calor y un intercambio calorífico
y másico entre vapores y líquidos. Cuando los componentes de la mezcla tienen punto
de ebullición diferente pero muy cercana, se usa este procedimiento de destilación.
Procedimiento:
Se
coloca la mezcla en un balón aforado que será gradualmente calentado en un
calentador, luego de calentarse se evaporara primero el componente de menor
punto de ebullición y luego del otro componente. Con el tiempo la primera
sustancia se enfriara y se va a condensar de nuevo en el frasco y la otra seguirá
subiendo hasta encontrarse con el condensador.
Hay
un termómetro para poder mantener la mezcla a una temperatura constante, un poco
mayor a la de ebullición. Cuando termine el procedimiento, en el balón habrá la
sustancia menos volátil y en el vaso precipitado estará el líquido más volátil.
Representación gráfica de la destilación
fraccionada
Equilibrio
Liquido-Vapor
Solubilidad (solido-liquido)
La solubilidad es la capacidad que tiene una
sustancia de poder disolverse en otra sustancia que se llama solvente (como el
Nestea en agua). En los términos químicos existen 3 tipos de disoluciones:
Ø Insaturada: es
cuando la en la mezcla hay mucho más solvente que soluto y todavía no ha
llegado al punto en el que no se pueda disolver más soluto en ella.
Ø Saturada: es cuando
en la disolución se llegó a un punto “máximo” en el cual ya no se puede
disolver más soluto en la disolución.
Ø Sobresaturada: es
cuando se lleva la disolución a ciertas condiciones específicas y se puede
hacer que sobrepase el punto “máximo” de admisión de soluto y pueda aceptar más.
No siempre se podrán disolver varios tipos de
solutos en un solvente en común. Por ejemplo, en el agua, no se puede disolver
aceite ni gasolina, peros si puede disolverse la sal y el alcohol. Existen
muchos factores que afecten a la solubilidad entre un soluto y un solvente, se podría
deber a las fuerzas intermoleculares de cada una, el cambio de entropía de la solvatación
y factores como la temperatura y la presión.
Grafica de solubilidad de varios
solutos contra 100 g de agua y su variación
Cuando
una disolución se le agrego mucho más soluto del que puede aceptar el solvente,
las partículas de soluto vana tender a “precipitar” al fondo del vaso o
recipiente donde se encuentre la mezcla.
Cuando
en una disolución saturada en agua pura y en equilibrio con el precipitado, con
una temperatura que no varié con el tiempo, la máxima cantidad de solido que
este disuelto en una disolución define la solubilidad del soluto que precipito “s”
la cual que se expresa en G/mol o moles/litro.
Si
colocamos el ejemplo de un electrolito AB que se va disolviendo en agua, se tendrá
el equilibrio heterogéneo del sólido y la solución disuelta
El
sólido en el equilibrio se mantiene constante, el producto de solubilidad (Ks) es
igual al producto de las actividades de los iones del solido poco soluble en la
disolución saturada, como son consideradas sustancias pocos solubles, la
solubilidad será muy pequeña, ya que se esta trabajando con disoluciones
diluidas, se pueden colocar las concentraciones:
Ejemplo:
Curva de enfriamiento
Las
curvas de enfriamiento son representaciones graficas de una temperatura o una
temperatura inicial de algún material con respecto al tiempo conforme este
mismo se enfrié. Ya que es una curva de “enfriamiento” la temperatura debe
disminuir cuando el tiempo avanza.
Un
ejemplo del análisis de una curva de enfriamiento seria:
En la curva de enfriamiento
del experimento 1 se observa que presenta una zona isotérmica a temperaturas relativamente
altas, lo cual indica que se trata de un metal puro. Considerando que el
experimento se realizó a temperatura ambiente, el cero de referencia toma esta temperatura
(25ºC). La isoterma observada es de 332ºC. Comparando con los elementos metálicos de la
tabla periódica, se puede observar que los resultados obtenidos en cuanto a la temperatura
de fusión del elemento, se aproximan a los valores mostrados por el plomo.
Los diagramas de enfriamiento
son una herramienta para poder estudiar los cambios de fase. Si en una
propiedad intensiva del material cambia, como la temperatura, si hay alguna
discontinuidad, es que hubo un cambio de fase.
En este caso se observan varios cambios
de pendiente lo que nos indica tratarse de una aleación, ya que no posee una
temperatura de solidificación específica. El primer cambio dependiente a 217°C
y representa el comienzo de la solidificación, a 177°C se observa una línea
horizontal que representa una reacción isotérmica que por tratarse de una aleación
Pb-Sn se trata de una reacción eutéctica (L (Pb)
+ (βSn)). Luego de transcurrido un tiempo (199seg) se observa la
culminación de la solidificación. Ubicándonos en el diagrama de equilibrio
Pb-Sn observamos que existen dos posibles aleaciones para la temperatura a la
que comienza la solidificación: 48%Pb-52% Sn (Hipoeutéctica) o 16%Pb-84%Sn
(Hipereutéctica).
NOTA: todas las gráficas,
análisis y experimentos, fueron obtenidas por el trabajo de curva de
enfriamiento del trabajo de: laboratorio de Metalurgia II por Oriana amache y Félix
Yépez de la sección 02.
Diagrama eutéctico
Los diagramas eutecticos son diagramas de fases, en
el que se representa cada fase de una mezcla (de 2 sustancias) cuando la presión
se mantiene constante. Pero si se quiere observar la de tres sustancias, es muy
complejo ya que es en 3D, así que solo la presión se hace constante y varia la
temperatura y la concentración de sustancias puras o casi puras.
Lo
que caracteriza a los diagramas de ser “eutécticos” es que los componentes de
la mezcla, uno en frente del otro, empiezan a disminuir el punto de fusión,
pero no indefinidamente, se llega a un punto máximo que se le dé dice “punto eutéctico”.
Solubilidad total en estado sólido: presenta únicamente
líneas de líquido y sólido, forman soluciones sólidas.
La
miscibilidad es la propiedad de líquidos para mezclarse en cualquier proporción,
formando una solución homogenea











Comentarios
Publicar un comentario