EQUILIBRIO DE FASES DE SISTEMAS BINARIOS
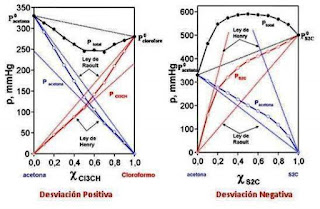
Equilibrio Liquido-Vapor Desviaciones con respecto a la ley de Raoult Cuando en un sistema hay una interacción entre las moléculas de los componentes A y B, la presencia de alguna de ellas afectara a la tendencia del escape de la otra. Existen dos tipos de desviaciones de la ley de Raoult: las desviaciones negativas y las positivas. Ø Desviacion positiva de la ley de Raoult: Cuando se sabe que el compuesto B tiene fuerzas intermoleculares mayores que las de A, ocurrirá que agregar más moléculas de B al líquido A será aumentar el escape de este último; así tendrá como resultado que la presión de vapor de A será mayor que la del líquido puro. Ø Desviación negativas de la ley de Raoult: Cuando las moléculas de A tienen fuerza de interacción mucho más fuertes contra B que consigo mismas, la presión de vapor del componente A será menor que la del liquido puro. Grafica de cómo son las desviaciones Azeótropo Es una mezcla que tiene una composición...